Derrière sa frimousse amusante et ses allures de petit bandit masqué, le raton laveur cache une réalité bien moins charmante. Ce mammifère originaire d’Amérique du Nord, longtemps perçu comme un animal mignon et inoffensif, est aujourd’hui classé en France l’une des espèces exotiques les plus envahissantes. Son expansion fulgurante inquiète les scientifiques autant que les particuliers.  Impossible d’en connaître le nombre exact, mais les estimations évoquent désormais plusieurs dizaines de milliers d’individus, avec une concentration majeure dans le nord-est du pays. C’est là qu’il s’est implanté dans les années 1950, introduit, pas toujours accidentellement, par des militaires américains de l’OTAN qui en faisaient parfois des animaux de compagnie. Sur les quelque 12 000 espèces exotiques recensées en Europe, seulement 1 % deviennent réellement problématiques, rappelle Jean-François Maillard, chercheur à l’OFB, et le raton laveur figure malheureusement dans cette catégorie. Très opportuniste, capable de s’installer en forêt comme en zone urbaine, de grimper, nager, fouiller ou crocheter des fermetures, il s’adapte à tous les environnements. Sur la faune sauvage, son impact est préoccupant : prédateur habile, il consomme aussi bien des oiseaux nicheurs que des amphibiens. Si, dans son milieu d’origine, le raton laveur doit composer avec de nombreux prédateurs, il n’en a pas chez nous. Sa population ne cesse donc d’augmenter et sa reproduction, rapide, associée à son intelligence et à son opportunisme alimentaire, rend sa gestion complexe. Les scientifiques insistent : sans action coordonnée, sa présence pourrait profondément transformer certains milieux naturels.
Impossible d’en connaître le nombre exact, mais les estimations évoquent désormais plusieurs dizaines de milliers d’individus, avec une concentration majeure dans le nord-est du pays. C’est là qu’il s’est implanté dans les années 1950, introduit, pas toujours accidentellement, par des militaires américains de l’OTAN qui en faisaient parfois des animaux de compagnie. Sur les quelque 12 000 espèces exotiques recensées en Europe, seulement 1 % deviennent réellement problématiques, rappelle Jean-François Maillard, chercheur à l’OFB, et le raton laveur figure malheureusement dans cette catégorie. Très opportuniste, capable de s’installer en forêt comme en zone urbaine, de grimper, nager, fouiller ou crocheter des fermetures, il s’adapte à tous les environnements. Sur la faune sauvage, son impact est préoccupant : prédateur habile, il consomme aussi bien des oiseaux nicheurs que des amphibiens. Si, dans son milieu d’origine, le raton laveur doit composer avec de nombreux prédateurs, il n’en a pas chez nous. Sa population ne cesse donc d’augmenter et sa reproduction, rapide, associée à son intelligence et à son opportunisme alimentaire, rend sa gestion complexe. Les scientifiques insistent : sans action coordonnée, sa présence pourrait profondément transformer certains milieux naturels.
Faune sauvage : une espèce à découvrir… ou redécouvrir


 Si l’idée d’un futur sanglier français aussi massif que les géants anatoliens intrigue, elle nécessite de comprendre les mécanismes biologiques qui influencent la croissance d’un grand mammifère. Car si les sangliers partagent la même espèce (Sus scrofa) les variations régionales sont liées à des conditions écologiques, génétiques et comportementales complexes. Sur le plan scientifique, la taille d’un sanglier dépend d’abord de trois facteurs majeurs : la génétique, la disponibilité alimentaire et la pression environnementale. Les populations turques possèdent un héritage génétique légèrement différencié, avec des lignées plus massives liées à un climat plus rude et des ressources abondantes en zones agricoles irriguées. En France, l’accès facilité à des sources riches (maïs, glands, châtaignes, betteraves, cultures énergétiques) favorise aussi la prise de poids. Le dérèglement climatique, en réduisant les périodes de restriction alimentaire, contribue à une croissance continue. Cependant, la génétique seule ne suffit pas : pour qu’un « sous-type » plus grand se fixe durablement dans une population, il faut plusieurs générations soumises à la même pression de sélection (abondance alimentaire, faible mortalité, absence de concurrence)...
Si l’idée d’un futur sanglier français aussi massif que les géants anatoliens intrigue, elle nécessite de comprendre les mécanismes biologiques qui influencent la croissance d’un grand mammifère. Car si les sangliers partagent la même espèce (Sus scrofa) les variations régionales sont liées à des conditions écologiques, génétiques et comportementales complexes. Sur le plan scientifique, la taille d’un sanglier dépend d’abord de trois facteurs majeurs : la génétique, la disponibilité alimentaire et la pression environnementale. Les populations turques possèdent un héritage génétique légèrement différencié, avec des lignées plus massives liées à un climat plus rude et des ressources abondantes en zones agricoles irriguées. En France, l’accès facilité à des sources riches (maïs, glands, châtaignes, betteraves, cultures énergétiques) favorise aussi la prise de poids. Le dérèglement climatique, en réduisant les périodes de restriction alimentaire, contribue à une croissance continue. Cependant, la génétique seule ne suffit pas : pour qu’un « sous-type » plus grand se fixe durablement dans une population, il faut plusieurs générations soumises à la même pression de sélection (abondance alimentaire, faible mortalité, absence de concurrence)... Depuis plusieurs décennies, les populations de sangliers progressent à un rythme inédit. En France comme dans de nombreux pays européens, cette expansion résulte de multiples facteurs : les transformations agricoles, l’augmentation des surfaces cultivées en maïs et autres plantes appétentes, les hivers plus doux constituent un environnement idéal pour leur reproduction. À cela s’ajoutent des pratiques cynégétiques parfois contradictoires : certains territoires ont, par le passé, privilégié le maintien de populations abondantes pour favoriser les battues, créant malgré eux un déséquilibre que l’on peine aujourd’hui à résorber. Les conséquences de cette surpopulation sont bien réelles. Les agriculteurs sont les premiers à s’en alarmer : parcelles ravagées, prairies retournées, cultures détruites… Les dégâts représentent chaque année des sommes considérables (proches désormais des 100 millions d’€), qui pèsent lourdement sur les fédérations de chasseurs. Mais les impacts ne se limitent pas à l’économie agricole. Les écologues pointent également les perturbations profondes infligées aux écosystèmes : compétition avec d’autres espèces, modification des sols, prédation sur la faune au sol, raréfaction de ressources essentielles pour d’autres animaux. Dans certaines régions, les sangliers sont devenus un véritable facteur d’instabilité écologique...
Depuis plusieurs décennies, les populations de sangliers progressent à un rythme inédit. En France comme dans de nombreux pays européens, cette expansion résulte de multiples facteurs : les transformations agricoles, l’augmentation des surfaces cultivées en maïs et autres plantes appétentes, les hivers plus doux constituent un environnement idéal pour leur reproduction. À cela s’ajoutent des pratiques cynégétiques parfois contradictoires : certains territoires ont, par le passé, privilégié le maintien de populations abondantes pour favoriser les battues, créant malgré eux un déséquilibre que l’on peine aujourd’hui à résorber. Les conséquences de cette surpopulation sont bien réelles. Les agriculteurs sont les premiers à s’en alarmer : parcelles ravagées, prairies retournées, cultures détruites… Les dégâts représentent chaque année des sommes considérables (proches désormais des 100 millions d’€), qui pèsent lourdement sur les fédérations de chasseurs. Mais les impacts ne se limitent pas à l’économie agricole. Les écologues pointent également les perturbations profondes infligées aux écosystèmes : compétition avec d’autres espèces, modification des sols, prédation sur la faune au sol, raréfaction de ressources essentielles pour d’autres animaux. Dans certaines régions, les sangliers sont devenus un véritable facteur d’instabilité écologique... Leur mobilité peut cependant être trompeuse pour les chasseurs, dont les territoires sont bien plus petits que les espaces vitaux des animaux. Lorsqu’un sanglier quitte un secteur, il n’a souvent parcouru que quelques kilomètres, parfois seulement jusqu’à la commune voisine. Autrement dit, lorsqu’ils ne sont plus « chez nous », ils restent encore chez eux. Pour comprendre ces déplacements, des équipes de chercheurs et de naturalistes ont entrepris d’étudier les stratégies d’occupation de l’espace des sangliers, avec la participation précieuse des chasseurs. Ces études ont consisté à capturer, marquer et suivre plusieurs milliers d’animaux à l’aide de boucles auriculaires ou de colliers émetteurs. Les données recueillies ont permis de mieux cerner le comportement des sangliers selon le sexe, l’âge et le contexte environnemental. On a ainsi pu définir le domaine vital d’un individu ou d’une compagnie. À partir des points extrêmes de leurs déplacements, les chercheurs tracent une zone en forme de « patate » représentant l’aire maximale explorée. Sa taille varie selon le biotope : plus restreinte en forêt dense, plus étendue dans les zones agricoles. En moyenne, une compagnie stable exploite entre 2 000 et 5 000 hectares autour de ses zones de mise bas. À l’intérieur, certaines zones restent inexplorées, soit parce qu’elles sont inhospitalières, soit parce qu’elles n’offrent aucun intérêt alimentaire ou protecteur. Les sangliers se déplacent aussi entre plusieurs zones de repos, selon la météo, le dérangement ou simplement leur humeur du moment...
Leur mobilité peut cependant être trompeuse pour les chasseurs, dont les territoires sont bien plus petits que les espaces vitaux des animaux. Lorsqu’un sanglier quitte un secteur, il n’a souvent parcouru que quelques kilomètres, parfois seulement jusqu’à la commune voisine. Autrement dit, lorsqu’ils ne sont plus « chez nous », ils restent encore chez eux. Pour comprendre ces déplacements, des équipes de chercheurs et de naturalistes ont entrepris d’étudier les stratégies d’occupation de l’espace des sangliers, avec la participation précieuse des chasseurs. Ces études ont consisté à capturer, marquer et suivre plusieurs milliers d’animaux à l’aide de boucles auriculaires ou de colliers émetteurs. Les données recueillies ont permis de mieux cerner le comportement des sangliers selon le sexe, l’âge et le contexte environnemental. On a ainsi pu définir le domaine vital d’un individu ou d’une compagnie. À partir des points extrêmes de leurs déplacements, les chercheurs tracent une zone en forme de « patate » représentant l’aire maximale explorée. Sa taille varie selon le biotope : plus restreinte en forêt dense, plus étendue dans les zones agricoles. En moyenne, une compagnie stable exploite entre 2 000 et 5 000 hectares autour de ses zones de mise bas. À l’intérieur, certaines zones restent inexplorées, soit parce qu’elles sont inhospitalières, soit parce qu’elles n’offrent aucun intérêt alimentaire ou protecteur. Les sangliers se déplacent aussi entre plusieurs zones de repos, selon la météo, le dérangement ou simplement leur humeur du moment... Contrairement à certaines idées reçues, aucun sanglier n’est jamais mort de faim sous nos latitudes. Pourtant, depuis des décennies, la pratique de l’agrainage, distribution volontaire de maïs ou autres apports, s’est répandue dans les milieux forestiers et cynégétiques. D’abord conçue comme une technique de fixation, elle visait à maintenir les animaux sur un territoire de chasse donné, afin d’éviter qu’ils ne passent chez le voisin. Par la suite, elle s’est parfois transformée en un véritable nourrissage, notamment dans les zones où la densité de sangliers est élevée ou où les chasseurs souhaitent garantir un tableau conséquent. Cette pratique a pourtant ses limites. En concentrant les populations autour de points d’agrainage, on modifie leur comportement naturel, on accroît les risques sanitaires et on altère les équilibres écologiques. Des animaux suralimentés perdent en mobilité, deviennent moins farouches et nuisent à l’image d’une chasse respectueuse du gibier et de la nature. Le sanglier, gibier noble et rusé, mérite mieux que de devenir un animal domestiqué...
Contrairement à certaines idées reçues, aucun sanglier n’est jamais mort de faim sous nos latitudes. Pourtant, depuis des décennies, la pratique de l’agrainage, distribution volontaire de maïs ou autres apports, s’est répandue dans les milieux forestiers et cynégétiques. D’abord conçue comme une technique de fixation, elle visait à maintenir les animaux sur un territoire de chasse donné, afin d’éviter qu’ils ne passent chez le voisin. Par la suite, elle s’est parfois transformée en un véritable nourrissage, notamment dans les zones où la densité de sangliers est élevée ou où les chasseurs souhaitent garantir un tableau conséquent. Cette pratique a pourtant ses limites. En concentrant les populations autour de points d’agrainage, on modifie leur comportement naturel, on accroît les risques sanitaires et on altère les équilibres écologiques. Des animaux suralimentés perdent en mobilité, deviennent moins farouches et nuisent à l’image d’une chasse respectueuse du gibier et de la nature. Le sanglier, gibier noble et rusé, mérite mieux que de devenir un animal domestiqué... Depuis les premières sociétés humaines, la chasse n’était pas seulement une question de survie, mais un rapport au monde naturel. Suivre une piste, interpréter des traces, anticiper le déplacement d’un animal exigeaient patience, effort et intelligence. La poursuite était l’école de l’humilité : l’homme se mesurait à la nature dans un jeu d’incertitude dont il n’était pas toujours le vainqueur. C’est cette part d’imprévisible qui donnait à la chasse sa légitimité et son intensité morale. L’animal avait une chance, parfois minime certes, mais toujours réelle, d’échapper au prédateur humain. L’équité résidait dans cet équilibre fragile, dans cette reconnaissance implicite que la victoire ne devait pas être garantie. Or, dans de nombreuses pratiques contemporaines, la poursuite s’amenuise ou disparaît. L’affût fixe, la chasse depuis une cache ou à proximité d’un point d’appât réduisent l’aléa à presque rien. L’animal n’est plus poursuivi ; il est attendu. L’instant de la rencontre, autrefois fruit d’un long cheminement, devient prévisible, parfois même inévitable. Ces méthodes exigent une forme de connaissance : savoir où se placer, comprendre les habitudes du gibier, choisir le bon moment. Mais elles transforment la chasse en embuscade. La tension dramatique du suivi s’efface devant l’efficacité. Le chasseur n’est plus dans une relation de poursuite mais dans une logique d’optimisation...
Depuis les premières sociétés humaines, la chasse n’était pas seulement une question de survie, mais un rapport au monde naturel. Suivre une piste, interpréter des traces, anticiper le déplacement d’un animal exigeaient patience, effort et intelligence. La poursuite était l’école de l’humilité : l’homme se mesurait à la nature dans un jeu d’incertitude dont il n’était pas toujours le vainqueur. C’est cette part d’imprévisible qui donnait à la chasse sa légitimité et son intensité morale. L’animal avait une chance, parfois minime certes, mais toujours réelle, d’échapper au prédateur humain. L’équité résidait dans cet équilibre fragile, dans cette reconnaissance implicite que la victoire ne devait pas être garantie. Or, dans de nombreuses pratiques contemporaines, la poursuite s’amenuise ou disparaît. L’affût fixe, la chasse depuis une cache ou à proximité d’un point d’appât réduisent l’aléa à presque rien. L’animal n’est plus poursuivi ; il est attendu. L’instant de la rencontre, autrefois fruit d’un long cheminement, devient prévisible, parfois même inévitable. Ces méthodes exigent une forme de connaissance : savoir où se placer, comprendre les habitudes du gibier, choisir le bon moment. Mais elles transforment la chasse en embuscade. La tension dramatique du suivi s’efface devant l’efficacité. Le chasseur n’est plus dans une relation de poursuite mais dans une logique d’optimisation... De tels exploits ont nourri, au fil des siècles, un folklore rural foisonnant : testicules séchés, bile ou urine de sanglier étaient jadis vantés pour leurs prétendues vertus aphrodisiaques, reflet d’une fascination ancestrale pour la force de l’animal. Au-delà du mythe, la science a mis en lumière une réalité tout aussi fascinante : la paternité multiple. Des recherches génétiques menées par l’ONCFS en forêt d’Arc-en-Barrois ont révélé que plus de 60 % des portées de laies proviennent de plusieurs mâles. Chaque femelle s’accouple, en moyenne, avec deux à trois partenaires durant le rut, favorisant ainsi une descendance génétiquement diversifiée. Cette polyandrie améliorerait la survie et la robustesse des marcassins, même si le poids et la taille des fœtus n’en dépendent pas directement. La fécondité des laies varie enfin selon les conditions écologiques : les années de forte glandée, riches en fruits nutritifs, stimulent leur reproduction. Les chercheurs ont compté jusqu’à 8 corps jaunes par laie lors des bonnes saisons, contre 4 les années pauvres. Ces glands, riches en lysine, améliorent aussi la lactation, garantissant aux marcassins une croissance rapide et vigoureuse. Symbole de puissance et de vitalité, le sanglier incarne à la fois la force brute et la complexité du monde sauvage. Entre comportements instinctifs, stratégies adaptatives et mythes humains, le rut demeure un spectacle saisissant d’équilibre entre nature et culture.
De tels exploits ont nourri, au fil des siècles, un folklore rural foisonnant : testicules séchés, bile ou urine de sanglier étaient jadis vantés pour leurs prétendues vertus aphrodisiaques, reflet d’une fascination ancestrale pour la force de l’animal. Au-delà du mythe, la science a mis en lumière une réalité tout aussi fascinante : la paternité multiple. Des recherches génétiques menées par l’ONCFS en forêt d’Arc-en-Barrois ont révélé que plus de 60 % des portées de laies proviennent de plusieurs mâles. Chaque femelle s’accouple, en moyenne, avec deux à trois partenaires durant le rut, favorisant ainsi une descendance génétiquement diversifiée. Cette polyandrie améliorerait la survie et la robustesse des marcassins, même si le poids et la taille des fœtus n’en dépendent pas directement. La fécondité des laies varie enfin selon les conditions écologiques : les années de forte glandée, riches en fruits nutritifs, stimulent leur reproduction. Les chercheurs ont compté jusqu’à 8 corps jaunes par laie lors des bonnes saisons, contre 4 les années pauvres. Ces glands, riches en lysine, améliorent aussi la lactation, garantissant aux marcassins une croissance rapide et vigoureuse. Symbole de puissance et de vitalité, le sanglier incarne à la fois la force brute et la complexité du monde sauvage. Entre comportements instinctifs, stratégies adaptatives et mythes humains, le rut demeure un spectacle saisissant d’équilibre entre nature et culture. Rut et brame, chez le cerf, sont évidemment indissociables, bien que... Si l’on se réfère à la définition du rut, on lira : « Période au cours de laquelle la fécondation est possible chez les mammifères ». Pendant cette période dite « des chaleurs », les animaux recherchent donc l’accouplement. Selon cette première partie de définition, tirée du « Petit dictionnaire de la Médecine du gibier » de Bernard Colin, publié aux éditions du Gerfaut, le rut est lié à un phénomène physiologique, à savoir les chaleurs. La définition se poursuit en ces termes : « Chez la femelle, le rut correspond à la phase d’œstrus, au cours de laquelle il y a ovulation.
Rut et brame, chez le cerf, sont évidemment indissociables, bien que... Si l’on se réfère à la définition du rut, on lira : « Période au cours de laquelle la fécondation est possible chez les mammifères ». Pendant cette période dite « des chaleurs », les animaux recherchent donc l’accouplement. Selon cette première partie de définition, tirée du « Petit dictionnaire de la Médecine du gibier » de Bernard Colin, publié aux éditions du Gerfaut, le rut est lié à un phénomène physiologique, à savoir les chaleurs. La définition se poursuit en ces termes : « Chez la femelle, le rut correspond à la phase d’œstrus, au cours de laquelle il y a ovulation.  Le rut, chez les mâles, n’existe que si les femelles de la même espèce sont elles-mêmes en rut. Cette période, chez le cerf, correspond au brame ». Pourtant, on peut constater que le brame commence parfois très tôt, alors que les biches ne sont pas encore en chaleur, c’est-à-dire en rut. Dans l’ouvrage « Le cerf » (de Guy Bonnet et François Klein, aux éditions Hatier), il est indiqué que « le cri du mâle constitue la manifestation la plus caractéristique de la période de reproduction. Le vocable « brame » désigne d’ailleurs à la fois l’époque du rut et le cri du cerf ». D’où cette question : le brame est-il inclus dans la période du rut, ceci dans le sens où son apogée se situe au milieu de la période du rut et que, de part et d’autre de ce temps fort, il débute et se termine avec des fréquences de raire bien plus faibles ? C’est ce qu’ont observé les auteurs de l’ouvrage (Clutton-Brok, Guinness et Albon) : « Le cerf élaphe : comportement et écologie des deux sexes ». Ils ont consigné, au cours de 118 heures d’observation, le nombre de séquences de raires d’un cerf de 9 ans entre le début, le milieu et la fin du rut, respectivement du 20 septembre au 1er octobre, du 1er au 15 octobre, et du 15 au 25 octobre. Ces dates paraissent un peu tardives pour nous, mais précisons qu’elles concernent la population de l’île de Rhum, en Ecosse, où les études menées là-bas, confirment bien que le brame est inclus dans la longue période de rut...
Le rut, chez les mâles, n’existe que si les femelles de la même espèce sont elles-mêmes en rut. Cette période, chez le cerf, correspond au brame ». Pourtant, on peut constater que le brame commence parfois très tôt, alors que les biches ne sont pas encore en chaleur, c’est-à-dire en rut. Dans l’ouvrage « Le cerf » (de Guy Bonnet et François Klein, aux éditions Hatier), il est indiqué que « le cri du mâle constitue la manifestation la plus caractéristique de la période de reproduction. Le vocable « brame » désigne d’ailleurs à la fois l’époque du rut et le cri du cerf ». D’où cette question : le brame est-il inclus dans la période du rut, ceci dans le sens où son apogée se situe au milieu de la période du rut et que, de part et d’autre de ce temps fort, il débute et se termine avec des fréquences de raire bien plus faibles ? C’est ce qu’ont observé les auteurs de l’ouvrage (Clutton-Brok, Guinness et Albon) : « Le cerf élaphe : comportement et écologie des deux sexes ». Ils ont consigné, au cours de 118 heures d’observation, le nombre de séquences de raires d’un cerf de 9 ans entre le début, le milieu et la fin du rut, respectivement du 20 septembre au 1er octobre, du 1er au 15 octobre, et du 15 au 25 octobre. Ces dates paraissent un peu tardives pour nous, mais précisons qu’elles concernent la population de l’île de Rhum, en Ecosse, où les études menées là-bas, confirment bien que le brame est inclus dans la longue période de rut... Ce concept peut être illustré par une construction où des bâtons rigides (les os) sont maintenus ensemble par des câbles tendus (les tendons). Lorsqu’on combine ces éléments de manière harmonieuse, la structure reste stable même si elle est soumise à des mouvements ou des contraintes. Chez les oiseaux, ce système est naturellement intégré dans leurs pattes, permettant une position debout sans effort, même en plein sommeil. Pour comprendre ce mécanisme, les chercheurs ont développé un modèle numérique basé sur l'anatomie d’un petit oiseau. Ils ont simplifié les os, les muscles et les tendons pour en extraire l’essentiel : les tendons calcifiés et rigides des pattes jouent un rôle clé. Ces derniers agissent comme les câbles d’une structure de tenségrité, maintenant les os en place grâce à une tension constante. Ce système ingénieux assure la stabilité, même lorsque l’oiseau est soumis à des perturbations extérieures, comme le vent ou le mouvement d’une branche...
Ce concept peut être illustré par une construction où des bâtons rigides (les os) sont maintenus ensemble par des câbles tendus (les tendons). Lorsqu’on combine ces éléments de manière harmonieuse, la structure reste stable même si elle est soumise à des mouvements ou des contraintes. Chez les oiseaux, ce système est naturellement intégré dans leurs pattes, permettant une position debout sans effort, même en plein sommeil. Pour comprendre ce mécanisme, les chercheurs ont développé un modèle numérique basé sur l'anatomie d’un petit oiseau. Ils ont simplifié les os, les muscles et les tendons pour en extraire l’essentiel : les tendons calcifiés et rigides des pattes jouent un rôle clé. Ces derniers agissent comme les câbles d’une structure de tenségrité, maintenant les os en place grâce à une tension constante. Ce système ingénieux assure la stabilité, même lorsque l’oiseau est soumis à des perturbations extérieures, comme le vent ou le mouvement d’une branche... Les fleurs de lys sont en réalité les deux seules canines supérieures qui subsistent encore, et témoignent d’un passé lointain où les ancêtres du cerf portaient des canines beaucoup plus développées. Aujourd’hui, ces dents ont perdu toute fonction alimentaire : elles ne participent pas à la mastication et ne sont pas opposées à d’autres dents.
Les fleurs de lys sont en réalité les deux seules canines supérieures qui subsistent encore, et témoignent d’un passé lointain où les ancêtres du cerf portaient des canines beaucoup plus développées. Aujourd’hui, ces dents ont perdu toute fonction alimentaire : elles ne participent pas à la mastication et ne sont pas opposées à d’autres dents. 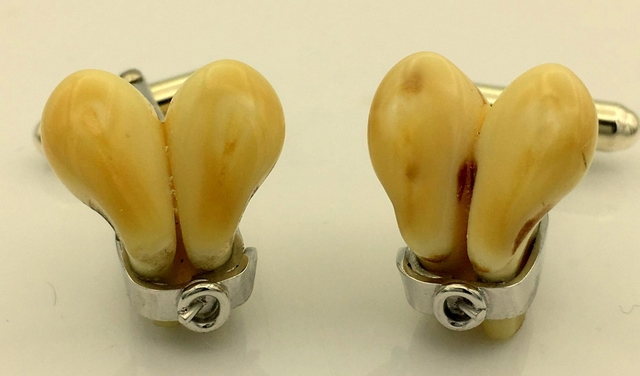 C’est pourquoi elles restent pratiquement intactes au cours de la vie de l’animal. On les retrouve implantées sur le segment de la mâchoire supérieure qui, à l’ordinaire, est dépourvu de dents. Leurs racines sont courtes, preuve de leur rôle devenu accessoire. Cette implantation superficielle explique qu’elles puissent être retirées relativement facilement, parfois simplement avec la pointe d’un couteau. La modestie actuelle de ces dents contraste avec leur importance dans le passé. Les représentations anciennes en témoignent. Dans « Le Livre de la Chasse » de Gaston Phébus (1389), une miniature intitulée « Le Brame » montre clairement des cerfs dont les canines dépassent de plusieurs centimètres en dehors de la bouche. Si l’artiste a respecté les proportions, ces crochets pouvaient mesurer cinq centimètres ou davantage, soit 3 à 4 fois plus des tailles actuelles (généralement entre 1 et 2 cm). Cette régression au fil du temps illustre bien la transformation morphologique des cervidés...
C’est pourquoi elles restent pratiquement intactes au cours de la vie de l’animal. On les retrouve implantées sur le segment de la mâchoire supérieure qui, à l’ordinaire, est dépourvu de dents. Leurs racines sont courtes, preuve de leur rôle devenu accessoire. Cette implantation superficielle explique qu’elles puissent être retirées relativement facilement, parfois simplement avec la pointe d’un couteau. La modestie actuelle de ces dents contraste avec leur importance dans le passé. Les représentations anciennes en témoignent. Dans « Le Livre de la Chasse » de Gaston Phébus (1389), une miniature intitulée « Le Brame » montre clairement des cerfs dont les canines dépassent de plusieurs centimètres en dehors de la bouche. Si l’artiste a respecté les proportions, ces crochets pouvaient mesurer cinq centimètres ou davantage, soit 3 à 4 fois plus des tailles actuelles (généralement entre 1 et 2 cm). Cette régression au fil du temps illustre bien la transformation morphologique des cervidés... Sept jeunes loups, bien vivants, vigoureux, filmés ensemble, prêts à se lancer bientôt dans la chasse aux dépens du bétail local. C’est un chiffre inédit, qui oblige déjà les scientifiques à revoir leurs calculs. Mais pour les éleveurs, il n’y a rien de scientifique : il y a surtout la peur, la lassitude et le sentiment d’être abandonnés. La préfète de Haute-Marne a tenté de rassurer en expliquant que cette découverte s’inscrit dans un « suivi constant » par l’OFB, mais ces paroles peinent à apaiser leur colère. Car derrière les discours, il y a la réalité : des attaques répétées, des troupeaux mutilés, des nuits sans sommeil à surveiller les enclos. Depuis le printemps, les signaux d’alerte s’accumulaient. Une femelle avait été photographiée, mamelles gonflées, signe évident de reproduction. Fin juillet, l’OFB confirmait la naissance de cinq louveteaux, événement présenté comme « historique » : une première reproduction en plaine depuis trente ans. Mais aujourd’hui, le « miracle de la nature », vanté par certains, se transforme en cauchemar pastoral. Car ils sont non pas cinq, mais sept, désormais sevrés, qui ne dépendent plus uniquement du lait maternel. Ils se nourrissent de viande régurgitée, de proies rapportées. Bientôt, ils apprendront à chasser par eux-mêmes. Si l’OFB souligne que des images les montrent parfois sur du gibier sauvage, les éleveurs savent trop bien qu’un troupeau de brebis offre une cible facile. Alors, comment peut-on se réjouir ? Comment présenter cette multiplication des loups comme une victoire écologique, quand elle sonne comme une condamnation pour tant d’hommes et de femmes qui vivent de leur bétail ? Ce qui est célébré par certains comme une « renaissance du sauvage » ressemble surtout, pour le monde paysan, à une lente descente aux enfers...
Sept jeunes loups, bien vivants, vigoureux, filmés ensemble, prêts à se lancer bientôt dans la chasse aux dépens du bétail local. C’est un chiffre inédit, qui oblige déjà les scientifiques à revoir leurs calculs. Mais pour les éleveurs, il n’y a rien de scientifique : il y a surtout la peur, la lassitude et le sentiment d’être abandonnés. La préfète de Haute-Marne a tenté de rassurer en expliquant que cette découverte s’inscrit dans un « suivi constant » par l’OFB, mais ces paroles peinent à apaiser leur colère. Car derrière les discours, il y a la réalité : des attaques répétées, des troupeaux mutilés, des nuits sans sommeil à surveiller les enclos. Depuis le printemps, les signaux d’alerte s’accumulaient. Une femelle avait été photographiée, mamelles gonflées, signe évident de reproduction. Fin juillet, l’OFB confirmait la naissance de cinq louveteaux, événement présenté comme « historique » : une première reproduction en plaine depuis trente ans. Mais aujourd’hui, le « miracle de la nature », vanté par certains, se transforme en cauchemar pastoral. Car ils sont non pas cinq, mais sept, désormais sevrés, qui ne dépendent plus uniquement du lait maternel. Ils se nourrissent de viande régurgitée, de proies rapportées. Bientôt, ils apprendront à chasser par eux-mêmes. Si l’OFB souligne que des images les montrent parfois sur du gibier sauvage, les éleveurs savent trop bien qu’un troupeau de brebis offre une cible facile. Alors, comment peut-on se réjouir ? Comment présenter cette multiplication des loups comme une victoire écologique, quand elle sonne comme une condamnation pour tant d’hommes et de femmes qui vivent de leur bétail ? Ce qui est célébré par certains comme une « renaissance du sauvage » ressemble surtout, pour le monde paysan, à une lente descente aux enfers... Elles peuvent rester collées sur le sol, sur la végétation ou parcourir plusieurs kilomètres via l’air. Ces « phérohormones » jouent donc divers rôles : marquer le territoire, signaler un statut sexuel ou de reproduction, déclencher une alarme, ou encore apaiser ou attirer un congénère.
Elles peuvent rester collées sur le sol, sur la végétation ou parcourir plusieurs kilomètres via l’air. Ces « phérohormones » jouent donc divers rôles : marquer le territoire, signaler un statut sexuel ou de reproduction, déclencher une alarme, ou encore apaiser ou attirer un congénère.  Le cerf élaphe illustre bien cette stratégie. Ses bois, exclusivement masculins, sont des vecteurs privilégiés de produits odorants, utilisés lorsqu’il frotte sa ramure contre des plantes odoriférantes. D’autres parties de son corps, comme les « larmiers », glandes frontales ou préorbitales situées près des yeux, libèrent des sécrétions odorantes permettant d’identifier l’individu. Les glandes interdigitales (entre les doigts) et métatarsales (sous le jarret) déposent aussi des signaux olfactifs quand l’animal gratte le sol, constituant des marqueurs territoriaux très personnels et complexes, signalant notamment le sexe ou l’état hormonal. Ces marquages olfactifs sont courants chez de nombreux cervidés, comme le chevreuil, le chamois, l’isard ou le mouflon, qui utilisent des glandes comparables (pré-orbitales, pédieuses, métatarsales, rétro-cornales) pour transmettre des signaux sociaux, territoriaux et reproducteurs. Concernant le sanglier, ses phéromones circulent principalement via la salive et l’urine, qui sont employées pour communiquer à longue distance. Le recours à des attractifs commerciaux en chasse illustre cet usage bien connu...
Le cerf élaphe illustre bien cette stratégie. Ses bois, exclusivement masculins, sont des vecteurs privilégiés de produits odorants, utilisés lorsqu’il frotte sa ramure contre des plantes odoriférantes. D’autres parties de son corps, comme les « larmiers », glandes frontales ou préorbitales situées près des yeux, libèrent des sécrétions odorantes permettant d’identifier l’individu. Les glandes interdigitales (entre les doigts) et métatarsales (sous le jarret) déposent aussi des signaux olfactifs quand l’animal gratte le sol, constituant des marqueurs territoriaux très personnels et complexes, signalant notamment le sexe ou l’état hormonal. Ces marquages olfactifs sont courants chez de nombreux cervidés, comme le chevreuil, le chamois, l’isard ou le mouflon, qui utilisent des glandes comparables (pré-orbitales, pédieuses, métatarsales, rétro-cornales) pour transmettre des signaux sociaux, territoriaux et reproducteurs. Concernant le sanglier, ses phéromones circulent principalement via la salive et l’urine, qui sont employées pour communiquer à longue distance. Le recours à des attractifs commerciaux en chasse illustre cet usage bien connu... Chaque oiseau, trouvé mort après avoir été admis dans des centres de soins, a fait l’objet d’une analyse ADN pour déterminer son sexe génétique (ZZ pour les mâles, ZW pour les femelles), et d’une dissection pour observer ses organes reproducteurs. Le résultat est surprenant : dans environ 5 % des cas (entre 4 % et 6,9 % selon l’espèce), le sexe génétique ne correspondait pas au sexe observé. Dans 92 % de ces cas, les oiseaux étaient génétiquement femelles (ZW) mais avaient des organes mâles pleinement développés. Un cas particulièrement marquant : un kookaburra génétiquement mâle (ZZ) présentait un oviducte distendu et de grands follicules, signes compatibles avec une ponte récente. Deux pigeons à crête présentaient quant à eux des tissus mixtes, testiculaires et ovariens. Ce type d’inversion de sexe est bien documenté chez d’autres vertébrés comme certains poissons, amphibiens ou reptiles. Toutefois, jusque-là, il était considéré comme extrêmement rare chez les oiseaux et les mammifères sauvages. En revanche, en laboratoire, l’inversion de sexe chez les oiseaux peut être induite par des manipulations hormonales (comme l’injection d’inhibiteurs de l’aromatase dans les œufs). Quant aux causes possibles de ce phénomène chez les oiseaux sauvages, les chercheurs n’ont actuellement aucune certitude. Néanmoins, ils soupçonnent fortement l’impact de facteurs environnementaux, en particulier les perturbateurs endocriniens (EDCs), ainsi que des niveaux élevés d’hormones de stress, qui peuvent altérer le développement sexuel. Les scientifiques appellent donc à étendre ce type de suivi à d’autres régions, notamment en Europe et en France, afin de vérifier si le phénomène est local ou plus généralisé.
Chaque oiseau, trouvé mort après avoir été admis dans des centres de soins, a fait l’objet d’une analyse ADN pour déterminer son sexe génétique (ZZ pour les mâles, ZW pour les femelles), et d’une dissection pour observer ses organes reproducteurs. Le résultat est surprenant : dans environ 5 % des cas (entre 4 % et 6,9 % selon l’espèce), le sexe génétique ne correspondait pas au sexe observé. Dans 92 % de ces cas, les oiseaux étaient génétiquement femelles (ZW) mais avaient des organes mâles pleinement développés. Un cas particulièrement marquant : un kookaburra génétiquement mâle (ZZ) présentait un oviducte distendu et de grands follicules, signes compatibles avec une ponte récente. Deux pigeons à crête présentaient quant à eux des tissus mixtes, testiculaires et ovariens. Ce type d’inversion de sexe est bien documenté chez d’autres vertébrés comme certains poissons, amphibiens ou reptiles. Toutefois, jusque-là, il était considéré comme extrêmement rare chez les oiseaux et les mammifères sauvages. En revanche, en laboratoire, l’inversion de sexe chez les oiseaux peut être induite par des manipulations hormonales (comme l’injection d’inhibiteurs de l’aromatase dans les œufs). Quant aux causes possibles de ce phénomène chez les oiseaux sauvages, les chercheurs n’ont actuellement aucune certitude. Néanmoins, ils soupçonnent fortement l’impact de facteurs environnementaux, en particulier les perturbateurs endocriniens (EDCs), ainsi que des niveaux élevés d’hormones de stress, qui peuvent altérer le développement sexuel. Les scientifiques appellent donc à étendre ce type de suivi à d’autres régions, notamment en Europe et en France, afin de vérifier si le phénomène est local ou plus généralisé.